β-glucanas: Efeitos imunomoduladores & Controle da mortalidade
Por Melina Bonato (Coordenadora de P&D, ICC Brasil)
Durante muito tempo, o método mais comum para o tratamento de infecções bacterianas na aquicultura foi a administração de antibióticos. No entanto, esta produção enfrenta sérios problemas devido aos diversos efeitos adversos desses medicamentos, tais como o acúmulo nos tecidos e na flora microbiana ambiental. Além disso, o uso de antibióticos ou vacinas para peixes é dispendioso e não está disponível em muitas fazendas de cultivo (Yousefian e Amiri, 2009). Assim, o uso de compostos ou aditivos incorporados na alimentação, visando o aumento da taxa de sobrevivência, resistência a doenças e o crescimento de peixes e camarões, tem sido explorado com mais frequência e mais sucesso.
Os peixes, de forma semelhante aos mamíferos, possuem sistema imune inato e adaptativo, sendo o inato responsável pelas respostas primárias, rápidas, não específicas e sem memória contra recontaminações. Já o sistema imune adaptativo é responsável por respostas específicas ou, em outras palavras, respostas intensas com anticorpos específicos para cada patógeno.
As células mais conhecidas do sistema imune inato são os macrófagos, neutrófilos, células dendríticas e células natural killer (Sharma, 2003). Os receptores do tipo Toll, localizados na superfície das células imunológicas, reconhecem padrões microbianos e induzem uma resposta imune inata imediata. Após essa ativação e a fagocitose, o fagócito apresenta um fragmento processado do patógeno ao sistema imune adaptativo e estimula uma resposta não-patogênica. Portanto, os fagócitos são chamados de células apresentadoras de antígenos. O reconhecimento do patógeno pelo sistema imune inato desencadeia defesas inatas imediatas e a ativação da resposta imune adaptativa (Lee & Iwasaki, 2007).
O ImmunoWall® da ICC Brasil é um produto composto pela parede celular de levedura Saccharomyces cerevisiae, proveniente do processo de fermentação da cana-de-açúcar para obtenção de etanol. Contém cerca de 35% de β-glucanas e 20% de mananoligossacarídeos (MOS). As β-glucanas são conhecidas como moduladoras ou estimulantes do sistema imune uma vez que, ao entrar em contato com os fagócitos, que reconhecem as ligações β-1,3 e 1,6 (Petravic-Tominac et al., 2010), os estimulam a produzir citocinas, iniciando uma reação em cadeia que induz a imunomodulação e melhora a capacidade de resposta do sistema imune inato (Figura 1).
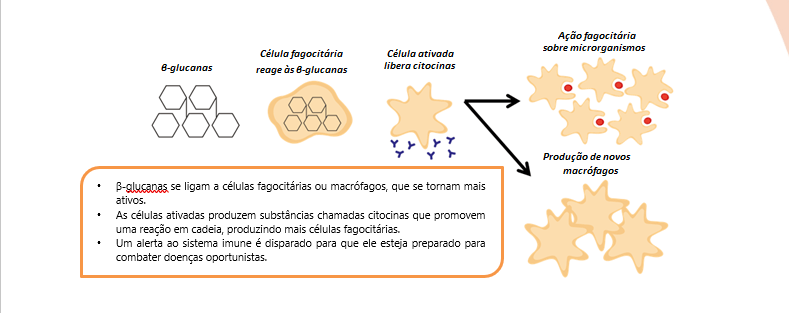
Figura 1. Os macrófagos habitam a mucosa intestinal. Quando em contato com as ß-Glucanas 1-3, 1-6, encontradas nas paredes celulares de levedura, a ativação do sistema imunológico é desencadeada.
Esse tipo de resposta é especialmente importante em animais durante o crescimento inicial, nas fases reprodutivas, em períodos de estresse e em desafios ambientais; agindo como agente profilático, aumentando a resistência do animal e minimizando efeitos negativos (tais como queda no desempenho ou altas taxas de mortalidade). A produção animal intensiva é um ambiente altamente desafiador, assim, o fortalecimento do sistema imunológico pode ser um dos fatores decisivos para obter maior produtividade.
O MOS é conhecido por sua capacidade de aglutinação de patógenos (principalmente aqueles com fimbria tipo 1), bem como, diversas cepas Gram-negativas. Oferece um sítio de ligação para os patógenos, impedindo a colonização do epitélio intestinal. Essas bactérias aglutinadas serão excretadas junto com a parte indigesta da fibra (Figura 2).
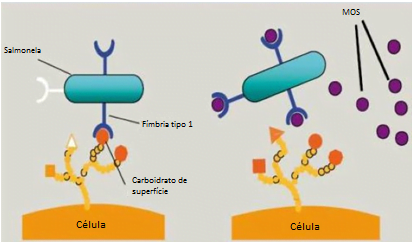
Figura 2. Esquema de patógenos com fímbrias tipo I aderente às células do intestino (lado esquerdo) e na presença de MOS (lado direito).
Em um estudo recente, realizado na Faculdade de Medicina Veterinária, Universidade do Cairo, no Egito, por Abu-Elala, et al. (dados não publicados), 270 Oreochromis niloticus (50,7 ± 0,8 g de PC) foram divididos em 3 grupos experimentais: Controle, 0,1% e 0,2% de ImmunoWall®; sendo 90 peixes para cada grupo de tratamento (3 repetições/tanque). Durante 2 meses o desempenho dos peixes foi medido a cada 2 semanas e, ao final do experimento, 5 peixes/repetição foram eutanasiados para avaliação dos parâmetros clinicopatológicos, oxidantes e antioxidantes, PCR quantitativa relativa de expressão gênica imune, atividade e índice fagocitários (%) e atividade da lisozima (µg/mL). Após 2 meses, os peixes foram desafiados contra bactérias Gram-positivas Lactococcus garvieae e Gram-negativas Aeromonas hydrophila e as taxas de mortalidade foram observadas durante 1 semana.
Aos dois meses, a suplementação de ImmunoWall® a 0,2% melhorou o peso corporal em 25,9 g em comparação com o grupo controle, aumentou o ganho de peso em 46,36% e reduziu a conversão alimentar em 21% em comparação ao grupo controle (P<0,05) .
ImmunoWall® melhorou os resultados clinicopatológicos (WBCs, TP e globulina) bem como a expressão de PCR quantitativa relativa IL1-β e atividades fagocitária e da lisozima (P<0,05). Foi observada um aumento das atividades enzimáticas da catalase e G-redutase com a suplementação de ImmunoWall® (P<0,05). Após o desafio com Lactococcus gravaeie e Aeromonas hydrophila, a mortalidade diminuiu (P <0,05) em ambos os grupos com a suplementação de ImmunoWall® (Tabela 1).
Tabela 1. Desempenho, resultados clinicopatológicos, estresse oxidativo, expressão de genes relacionados à imunidade, imunidade inata e parâmetros de mortalidade de O. niloticus.
| Parâmetros | Controle | 0,1% de Immunowall® | 0,2% de Immunowall® |
| PC (g) 2 meses | 94,86b | 118,5a | 120,8a |
| GP (g) | 48,1b | 67,8a | 70,4a |
| CA | 2,1b | 1,73a | 1,66a |
| WBCs | 130b ± 13,02 | 201a ± 20,13 | 156b ± 15,62 |
| TP | 2,23b±0,25 | 2,97a ± 0,23 | 2,27b ± 0,27 |
| Globulina | 1,21b±0,12 | 1,94a ± 0,13 | 1,16b ± 0,12 |
| Catalase | 268,73b ± 25,39 | 588,73a ± 42,05 | 618,3a ± 60,7 |
| G-redutase | 142,70c ± 3,55 | 192,93b ± 21,25 | 269,27a ± 20,61 |
| IL1-β | 0b | 7,5b ± 1,1 | 16a ± 1,3 |
| Atividade fagocitária (%) | 57b | 61a | 70ª |
| Índice de fagocitose | 1,8b | 1,75b | 2,5ª |
| Atividade da lisozima (µg\ml) | 435,8b | 450,95a | 464,3ª |
| Percentual de mortalidade com L. gravieae | 90b | 50a | 60ª |
| Percentual de mortalidade com A. hydrophila | 100b | 40a | 50a |
ab Médias com letras diferentes, na mesma linha, diferem significativamente pelo teste de Tukey (P<0,05). PC: peso corporal. GP: ganho de peso. CA: conversão alimentar. WBCs: glóbulos brancos. TP: proteína total.
Em conclusão, as inclusões de 0,1 e 0,2% de ImmunoWall® melhoraram a resposta clinicopatológica e a imunidade inata. A suplementação com ImmunoWall® aumentou a atividade de enzimas oxidativas e reduziu as taxas de mortalidade quando os peixes foram desafiados com Lactococcus gravaeie e Aeromonas hydrophila, em comparação ao grupo controle. A diminuição nas taxas de mortalidade após os desafios foi consistente e representou, pelo menos, 50% a mais em sobrevivência nos casos em que há 100% de mortalidade devido à contaminação por patógenos.
Outros estudos foram publicados sobre os benefícios da suplementação da parede celular de levedura na aquicultura. Ebrahimi, G. et al., (2011) estudando alevinos de carpa comum (Cyprinus carpio) infectados com Aeromonas hydrophila, observou um aumento significativo na taxa de sobrevivência, número de leucócitos e melhora nos resultados de conversão alimentar em grupos alimentados com dietas com 1 a 2,5% de ImmunoWall®. Ebrahimi (2010) relatou diminuição na contagem total de bactérias intestinais, aumento na taxa de sobrevivência e melhora da conversão alimentar de alevinos Rutilus frisii Kutum alimentados com ImmunoWall® de 0,5 a 2,5%. Karimzadeh et al., (2013) estudando larvas de Rutilus kutum, observaram melhora na taxa de sobrevivência, peso corporal final e conversão alimentar, bem como diminuição na contagem total de bactérias intestinais com suplementação de 0,5% de ImmunoWall®.
O aprimoramento e a modulação do sistema imunológico inato podem ser uma das estratégias para combater a contaminação, reduzir a mortalidade e melhorar a produtividade. Se a parede celular de levedura for fornecida precocemente aos animais, o sistema imunológico será modulado e estará alerta para diversas infecções ou contaminações. A ação da β-glucana ocorre no sistema imune inato, ou seja, onde ocorre a primeira resposta imune à contaminação patogênica, evitando maior gasto energético durante um processo inflamatório prolongado e mobilizando mais rapidamente o sistema imune adaptativo, o que evitará perdas de produção e altas taxas de mortalidade.
Referências
Abu-Elala, N. M., et al. (2018) Dietary influence of Immunowall® on the growth performance, haematological\oxidative stress parameters and immunity of cultured Oreochromis niloticus (dados não publicados).
Ebrahimi, G. (2010) Effects of prebiotic supplementation on survival, growth performance and feed utilization of Kutum, Rutilus frisii (Kamenskii), fingerlings. Research Journal of Animal Science, 4 (6): 125-129.
Ebrahimi, G. et al. (2012) Effects of a prebiotic, Immunogen®, on feed utilization, body composition, immunity and resistance to Aeromonas hydrophila infection in the common carp Cyprinus carpio (Linnaeus) fingerlings. Journal of Animal Physiology and Animal Nutrition, 96: 591-599.
Karimzadeh, S. et al. (2013) Effects of Different Levels of Immunogen® on Growth Performance, Intestinal Bacteria Colonization and Survival Rate in Rutilus kutum Larvae. World Journal of Fish and Marine Sciences 5 (6): 664-669.
Lee, H. K., A. (2007) Iwasaki. Innate control of adaptive immunity: dendritic cells and beyond. Semin. Immunol., n. 19, p.48-55.
Lee, H. K. and A. Iwasaki (2007). Innate control of adaptive immunity: dendritic cells and beyond. Semin. Immunol., n. 19, p.48-55.
Petravić-Tominac, V. et al. (2010). Biological effects of yeast β-glucans. Agriculturae Conspectus Scientificus, n. 75, v. 4.
Sharma, J. M. (2003). The avian immune system. In: Saif, Y. M. (ed.), Diseases of Poultry, 11th ed., Iowa State Press, Ames, IA, pp. 5-16.
Yousefian, M. and Amiri, M.S. (2009). A review of the use of prebiotic in aquaculture for fish and shrimp. African Journal of Biotechnology. Vol. 8 (25), pp. 7313-7318.
*Informações sobre a autora: Melina Bonato é Ph.D. em Ciência Animal. Desde 2013, coordena o departamento de pesquisa e desenvolvimento da ICC Brazil, com foco em produtos baseados em leveduras e seu efeito na resposta imunológica, saúde, desempenho e nutrição animal.
Publicado em 25 junho de 2019


