β-glucanas: Efectos inmunomoduladores y control de la mortalidad
Melina Bonato (Coordinadora de I&D, ICC Brasil)
Durante mucho tiempo, el método más común para el tratamiento de infecciones bacterianas en la acuicultura fue la administración de antibióticos. Sin embargo, esta producción enfrenta serios problemas debido a los diversos efectos adversos de esos medicamentos, tales como el acúmulo en los tejidos y en la flora microbiana ambiental. Además, el uso de antibióticos o vacunas para peces es caro y no está disponible en muchas haciendas de cultivo (Yousefian y Amiri, 2009). Así, el uso de compuestos o aditivos incorporados a la alimentación, visando el aumento de la tasa de sobrevivencia, resistencia a enfermedades y el crecimiento de peces y camarones, ha sido explorado con más frecuencia y más éxito.
Los peces, de forma semejante a los mamíferos, poseen sistema inmune innato y adaptativo, siendo el innato responsable por las respuestas primarias, rápidas, no específicas y sin memoria contra recontaminaciones. Ya el sistema inmune adaptativo es responsable por respuestas específicas o, en otras palabras, respuestas intensas con anticuerpos específicos para cada patógeno.
Las células más conocidas del sistema inmune innato son los macrófagos, neutrófilos, células dendríticas y células natural killer (Sharma, 2003). Los receptores del tipo Toll, localizados en la superficie de las células inmunológicas, reconocen patrones microbianos e inducen una respuesta inmune innata inmediata. Después de esa activación y la fagocitosis, el fagocito presenta un fragmento procesado del patógeno al sistema inmune adaptativo y estimula una respuesta no-patogénica. Por lo tanto, se les llaman a los fagocitos células presentadoras de antígenos. El reconocimiento del patógeno por el sistema inmune innato desencadena defensas innatas inmediatas y la activación de la respuesta inmune adaptativa (Lee & Iwasaki, 2007).
ImmunoWall® de ICC Brasil es un producto compuesto por la pared celular de levadura Saccharomyces cerevisiae, proveniente del proceso de fermentación de la caña-de-azúcar para obtención de etanol. Contiene cerca del 35% de β-glucanos y el 20% de mananoligosacáridos (MOS). Se conocen los β-glucanos como moduladoras o estimulantes del sistema inmune una vez que, al entrar en contacto con los fagocitos, que reconocen las ligaciones β-1,3 y 1,6 (Petravic-Tominac et al., 2010), los estimulan a producir citocinas, iniciando una reacción en cadena que induce la inmunomodulación y mejora la capacidad de respuesta del sistema inmune innato (Figura 1).
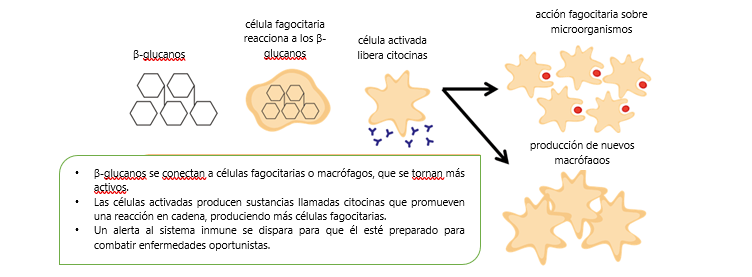
Figura 1. Los macrófagos habitan la mucosa intestinal. Cuando en contacto con los ß-Glucanos 1-3, 1-6, encontradas en las paredes celulares de levadura, la activación del sistema inmunológico se desencadena.
Ese tipo de respuesta es especialmente importante en animales durante el crecimiento inicial, en las fases reproductivas, en períodos de estrés y en desafíos ambientales; actuando como agente profiláctico, aumentando la resistencia del animal y minimizando efectos negativos (tales como queda en el desempeño o altas tasas de mortalidad). La producción animal intensiva es un ambiente altamente desafiador, así, el fortalecimiento del sistema inmunológico puede ser uno de los factores decisivos para obtener mayor productividad.
Se conoce el MOS por su capacidad de aglutinación de patógenos (principalmente aquellos con fimbria tipo 1), como también, diversas cepas Gran-negativas. Ofrece un sitio de ligación para los patógenos, impidiendo la colonización del epitelio intestinal. Esas bacterias aglutinadas se excretarán junto con la parte indigesta de la fibra (Figura 2).
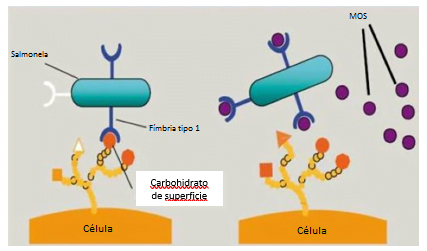
Figura 2. Esquema de patógenos con fimbrias tipo I adherentes a las células del intestino (lado izquierdo) y en la presencia de MOS (lado derecho).
En un estudio reciente, realizado en la Faculdade de Medicina Veterinária, Universidade del Cairo, en Egipto, por Abu-Elala, et al. (datos no publicados), 270 Oreochromis niloticus (50,7 ± 0,8 g de PC) fueron divididos en 3 grupos experimentales: Control, 0,1% y 0,2% de ImmunoWall®; siendo 90 peces para cada grupo de tratamiento (3 repeticiones/tanque). Durante 2 meses el desempeño de los peces fue medido a cada 2 semanas y, al final del experimento, 5 peces/repetición fueron sacrificados para evaluación de los parámetros clínico-patológicos, oxidantes y antioxidantes, PCR cuantitativa relativa de expresión génica inmune, actividad e índice fagocitarios (%) y actividad de la lisozima (µg/mL). Después de 2 meses, los peces fueron desafiados contra bacterias Gran-positivas Lactococcus garvieae y Gran-negativas Aeromonas hydrophila y las tasas de mortalidad fueron observadas durante 1 semana.
A los dos meses, la suplementación de ImmunoWall® al 0,2% mejoró el peso corporal en 25,9 g en comparación al grupo control, aumentó la ganancia de peso en el 46,36% y redujo la conversión alimentar en el 21% en comparación al grupo controle (P<0,05) .
ImmunoWall® mejoró los resultados clínico-patológicos (WBCs, TP y globulina) como también la expresión de PCR cuantitativa relativa IL1-β y actividades fagocitarias y de la lisozima (P<0,05). Se observó un aumento de las actividades enzimáticas de la catalasa y G-reductasa con la suplementación de ImmunoWall® (P<0,05). Después del desafío con Lactococcus garvieae y Aeromonas hydrophila, la mortalidad disminuyó (P 0,05) en ambos grupos con la suplementación de ImmunoWall® (Tabla 1).
Tabla 1. Desempeño, resultados clínico-patológicos, estrés oxidativo, expresión de genes relacionados a la inmunidad, inmunidad innata y parámetros de mortalidad de O. niloticus.
| Parámetros | Control | 0,1% de Immunowall® | 0,2% de Immunowall® |
| PC (g) 2 meses | 94,86b | 118,5a | 120,8a |
| GP (g) | 48,1b | 67,8a | 70,4a |
| CA | 2,1b | 1,73a | 1,66a |
| WBCs | 130b ± 13,02 | 201a ± 20,13 | 156b ± 15,62 |
| TP | 2,23a±0,25 | 2,97b ± 0,23 | 2,27a ± 0,27 |
| Globulina | 1,21a±0,12 | 1,94 b ± 0,13 | 1,16a ± 0,12 |
| Catalasa | 268,73b ± 25,39 | 588,73a ± 42,05 | 618,3a ± 60,7 |
| G-redutasa | 142,70c ± 3,55 | 192,93b ± 21,25 | 269,27a ± 20,61 |
| IL1-β | 0b | 7,5b ± 1,1 | 16a ± 1,3 |
| Actividad fagocitaria (%) | 57b | 61a | 70ª |
| Índice de fagocitosis | 1,8b | 1,75b | 2,5ª |
| Actividad de la lisozima (µg\ml) | 435,8b | 450,95a | 464,3ª |
| Porcentual de mortalidad con L. garvieae | 90b | 50a | 60ª |
| Porcentual de mortalidad con A. hydrophila | 100b | 40a | 50a |
ab Promedios con letras diferentes, en la misma línea, difieren significativamente por el test de Tukey (P<0,05). PC: peso corporal. GP: ganancia de peso. CA: conversión alimentícia. WBCs: glóbulos blancos. TP: proteína total.
En conclusión, las inclusiones del 0,1 y 0,2% de ImmunoWall® mejoraron la respuesta clínico-patológica y la inmunidad innata. La suplementación con ImmunoWall® aumentó la actividad de enzimas oxidativas y redujo las tasas de mortalidad cuando los peces fueron desafiados con Lactococcus garvieae y Aeromonas hydrophila, en comparación al grupo control. La disminución en las tasas de mortalidad después de los desafíos fue consistente y ha representado, por lo menos, el 50% más en sobrevivencia en los casos en los que hay el 100% de mortalidad debido a la contaminación por patógenos.
Se publicaron otros estudios sobre los beneficios de la suplementación de la pared celular de levadura en la acuicultura. Ebrahimi, G. et al., (2011) estudiando alevinos de carpa común (Cyprinus carpio) infectados con Aeromonas hydrophila, observó un aumento significativo en la tasa de sobrevivencia, número de leucocitos y mejora en los resultados de conversión alimentar en grupos alimentados con dietas del 1 al 2,5% de ImmunoWall®. Ebrahimi (2010) relató disminución en el recuento total de bacterias intestinales, aumento en la tasa de sobrevivencia y mejora de la conversión alimentar de alevinos Rutilus frisii Kutum alimentados con ImmunoWall® del 0,5 al 2,5%. Karimzadeh et al., (2013) estudiando larvas de Rutilus kutum, observaron mejora en la tasa de sobrevivencia, peso corporal final y conversión alimentar, como también disminución en el recuento total de bacterias intestinales con suplementación del 0,5% de ImmunoWall®.
La mejora y la modulación del sistema inmunológico innato pueden ser una de las estrategias para combatir la contaminación, reducir la mortalidad y mejorar la productividad. Si la pared celular de levadura es suministrada precozmente a los animales, el sistema inmunológico se modulará y estará alerta para diversas infecciones o contaminaciones. La acción de la β-glucana ocurre en el sistema inmune innato, es decir, donde ocurre la primera respuesta inmune a la contaminación patogénica, evitando mayor gasto energético durante un proceso inflamatorio prolongado y movilizando más rápidamente el sistema inmune adaptativo, lo que evitará pérdidas de producción y altas tasas de mortalidad.
Referencias
Abu-Elala, N. M., et al. (2018) Dietary influence of Immunowall® on the growth performance, haematological\oxidative stress parameters and immunity of cultured Oreochromis niloticus (dados não publicados).
Ebrahimi, G. (2010) Effects of prebiotic supplementation on survival, growth performance and feed utilization of Kutum, Rutilus frisii (Kamenskii), fingerlings. Research Journal of Animal Science, 4 (6): 125-129.
Ebrahimi, G. et al. (2012) Effects of a prebiotic, Immunogen®, on feed utilization, body composition, immunity and resistance to Aeromonas hydrophila infection in the common carp Cyprinus carpio (Linnaeus) fingerlings. Journal of Animal Physiology and Animal Nutrition, 96: 591-599.
Karimzadeh, S. et al. (2013) Effects of Different Levels of Immunogen® on Growth Performance, Intestinal Bacteria Colonization and Survival Rate in Rutilus kutum Larvae. World Journal of Fish and Marine Sciences 5 (6): 664-669.
Lee, H. K., A. (2007) Iwasaki. Innate control of adaptive immunity: dendritic cells and beyond. Semin. Immunol., n. 19, p.48-55.
Lee, H. K. and A. Iwasaki (2007). Innate control of adaptive immunity: dendritic cells and beyond. Semin. Immunol., n. 19, p.48-55.
Petravić-Tominac, V. et al. (2010). Biological effects of yeast β-glucans. Agriculturae Conspectus Scientificus, n. 75, v. 4.
Sharma, J. M. (2003). The avian immune system. In: Saif, Y. M. (ed.), Diseases of Poultry, 11th ed., Iowa State Press, Ames, IA, pp. 5-16.
Yousefian, M. and Amiri, M.S. (2009). A review of the use of prebiotic in aquaculture for fish and shrimp. African Journal of Biotechnology. Vol. 8 (25), pp. 7313-7318.
*Informaciones sobre la autora: Melina Bonato es Ph.D. en Ciencia Animal. Desde 2013, coordina el departamento de pesquisa y desarrollo de ICC Brazil, con foco en productos basados en levaduras y su efecto en la respuesta inmunológica, salud, desempeño y nutrición animal.
Publicado en 25 junio de 2019


