Fuentes proteicas sostenibles en las dietas de camarones

Fernando Augusto de Souza, Ph.D.
Técnico especialista en monogástricos, ICC Brazil
La proteína es el nutriente que más pesa en las dietas de los camarones, principalmente debido a la inclusión de harina de pescado (Oujifard et al, 2012). La calidad de la harina de pescado está determinada por una serie de factores, incluido el tipo de pescado utilizado, el método de procesamiento y las condiciones de almacenamiento. Las harinas de buena calidad suelen obtenerse de pescados con un alto valor nutricional, como la sardina, la anchoa y el atún.
Además de los factores de calidad, la disponibilidad de harina de pescado es sumamente limitante, al tratarse de un ingrediente finito que depende de la capacidad de renovación de los cardúmenes, es decir, es limitada e insostenible, obtenida de la pesca depredadora que en la mayoría de las ocasiones se produce, no respeta el ciclo de reproducción de los peces (Sookying et al, 2013). En este sentido, los recursos sostenibles se vuelven imprescindibles, con posibilidades de crecimiento y abastecimiento del mercado del camarón en el largo plazo.
Disponibilidad
Es posible reducir el uso de harina de pescado combinando otras proteínas menos costosas y con una combinación de aminoácidos que satisfaga los requerimientos del camarón. Algunas alternativas son: harina animal procedente del matadero de aves, cerdos y bovinos, harina de sangre secada por aspersión, levadura, proteínas de origen bacteriano, entre otras (Hu et al, 2013).
Las harinas de origen animal, como la harina de carne y huesos, contienen altos niveles de metionina, lo que teóricamente se convierte en una buena alternativa para sustituir la harina de pescado, pero es un producto cuyo uso está prohibido en dietas animales en algunos países de la Unión Europea, además de presentando algunos problemas de palatabilidad y contaminantes (Sweetman, 2008).
Las proteínas vegetales, como la harina de soja, se utilizan en la alimentación de peces y camarones como fuente alternativa de proteínas. Sin embargo, se debe prestar atención a los factores anti nutricionales, que pueden afectar negativamente el rendimiento animal, como: inhibidores de proteasas y taninos, anti-vitaminas y otras sustancias, como los fitoestrógenos (Francis, Makkar & Klaus 2001).
Actualmente, las levaduras representan una importante fuente de proteínas capaz de sustituir (total o parcialmente) la harina de pescado (Alloul et al, 2021). Es un ingrediente con amplia disponibilidad y precios competitivos. En Brasil actualmente se utiliza solo el 10% del total producido para alimentación animal, de una cantidad de 1 millón de toneladas, solo se utilizan 100 mil toneladas (UNICA, 2023).
Características nutricionales
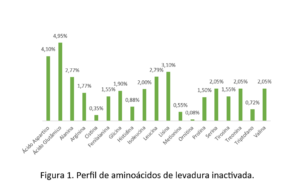
Las levaduras son un producto muy conocido en la acuicultura (enteras o fraccionadas) como fuente de aminoácidos (Figura 1), proteínas, minerales y vitaminas, con un efecto positivo sobre el crecimiento y la inmunidad del camarón (Gamboa-Delgado et al. 2016; Álvarez -Sánchez et al. 2018). Otro punto es la presencia de ácido glutámico y ácido aspártico, los cuales están relacionados con el proceso de atractivo y palatabilidad en las dietas (Heu et al, 2003).
El uso de la levadura varía según su procesamiento. Cuando sólo se inactivan y se secan, las levaduras se utilizan como fuente de proteínas y pueden proporcionar hasta un 45% de proteína con una digestibilidad cercana al 70%. Si se procesa, en el caso de la autólisis puede llegar al 80% y si se hidroliza supera el 80% (Rostagno et al, 2017). También hay casos en los que sólo se desea utilizar como alimento funcional, ya que son fuentes de β-glucanos y mananoligosacáridos, que a su vez ayudan a fortalecer el sistema inmunológico y se unen a los patógenos, respectivamente (Chi et al, 2006).
Sostenibilidad y Medio Ambiente
Las levaduras juegan un papel importante en el control y resistencia a diversas enfermedades. Según Ceseña et al. (2021) se pueden utilizar, además de su valor nutricional, como antioxidantes e inmunoestimulantes, lo que permite reducir el uso de antibióticos en la ganadería comercial.
Otro punto es la sostenibilidad del producto en su proceso productivo y con el medio ambiente. Las levaduras provenientes de la fabricación de etanol se insertan en una actividad con producción de carbono negativo y que ha logrado reducir en más de 630 millones de toneladas de CO2eq desde marzo de 2022 en Brasil, es decir, para lograr esta economía de CO2 sería necesario plantar más de 4.500 millones de árboles nativos en los próximos 20 años (UNICA, 2023).
También es un producto que permite reducir el uso de antibióticos, medicamentos y otros productos químicos, ya que no afecta al medio acuático. La calidad del agua es un punto muy importante para entender y controlar enfermedades y patógenos, además de evitar la contaminación ambiental, ya sea con moléculas que degradan el ambiente o microorganismos, o afectando la biodiversidad. Las levaduras ya forman parte del ambiente o microbiota de los organismos acuáticos y son capaces de mejorar el bienestar y la salud animal, influyendo en el ambiente microecológico (Deng et al, 2013). Los mismos autores observaron que con el uso de Saccharomyces cerevisiae directamente en el agua hubo una reducción en la cantidad de NH3, demanda química de oxígeno y sulfitos en el agua y sedimentos de la laguna.
Sistema inmunológico y prevención de enfermedades
El uso de levaduras y sus productos representa una estrategia posible y viable de prevención y control de enfermedades para mejorar la calidad y sostenibilidad de la producción acuícola. Varios estudios (Burgents et al. 2004; Zhenming et al. 2006: Sajeevan et al. 2009a,b; Bai et al. 2010, 2014; Babu et al. 2013; Deng et al. 2013; Sang et al. 2014; Wilson et al. 2015; Neto y Nunes 2015; Jin et al. 2018), demostraron efectos beneficiosos sobre componentes del sistema inmunológico del camarón, tales como: efectos sobre proteínas anticoagulantes, aglutinación de patógenos, efecto antioxidante, mejora en componentes humorales, Actividad de la lisozima, procesos de fagocitosis, entre otros.
Algunos estudios (Felix et al. 2008; Guo et al. 2016) han demostrado la eficacia del uso de levadura en condiciones de vibriosis sobre el rendimiento del camarón y contra el virus de la mionecrosis (IMNV) y el virus de la mancha blanca (WSSV) en L. vannamei (Sukumaran et al. 2010; Zhu et al, 2010; Neto & Nunes, 2015; Wilson et al. 2015). Estos resultados demuestran la actividad inmunoestimuladora de los β-glucanos 1,3 y 1,6 suplementados con levadura. Los inmunoestimulantes pueden aumentar la fagocitosis de patógenos activando las células fagocíticas en la hemolinfa, aumentando las propiedades antibacterianas y antisépticas de la hemolinfa, activando el sistema PROPO y mediando las señales de reconocimiento y fagocitosis (Bondad-Reantaso et al. 2005; Castex et al. 2010).
Junto a los β-glucanos en la pared celular de la levadura también se encuentran los mananoligosacáridos (MOS). Son un complejo de carbohidratos no digeribles que previenen la adhesión de bacterias patógenas porque actúa bloqueando la adhesión de las lectinas microbianas a los carbohidratos presentes en la superficie de las células intestinales. La no adherencia a la membrana intestinal inhibe la colonización del patógeno infeccioso, que se elimina en las heces (Genc et al. 2007; Zhang et al. 2012; Genc y Ebeoglu 2013; Sang et al. 2014).
Todos estos mecanismos, además de proporcionar mejoras productivas (Chi et al, 2016), también permiten una reducción de la mortalidad animal (Nimrat et al, 2019) resultante de los beneficios observados y la capacidad de respuesta de los animales ante los desafíos.
Consideraciones finales
El uso de levaduras en la alimentación de camarones es muy sólido en el sentido nutricional y funcional, es decir, son una fuente alternativa a la harina de pescado, con potencial de abastecimiento y abastecimiento a largo plazo, además de ser sustentables. Permiten reducir el uso de antibióticos y otros medicamentos ya que tienen un efecto directo modulando el sistema inmunológico y aglutinando patógenos, además de no dañar el medio acuático.
Referencias
Alloul, A.; Wille, M.; Lucenti, P.; Bossier, P.; Van Stappen, G.; Vlaeminck, S.E. Purple Bacteria as Added-Value Protein Ingredient in Shrimp Feed: Penaeus vannamei Growth Performance, and Tolerance against Vibrio and Ammonia Stress. Aquaculture 2021, 530, 735788.
Alvarez-Sanchez, A.R., Nolasco, H., Pena, A., Mejia, H. In vitro digestibility of Yarrowia lipolytica yeast and growth performance in whiteleg shrimp Litopenaeus vannamei. J Fish Aquat Sci, 18 (2018).
Babu, D. T., Antony, S. P., Joseph, S. P., Bright, A. R., & Philip, R. (2013). Marine yeast Candida aquaetextoris S527 as a potential immunostimulant in black tiger shrimp Penaeus monodon. Journal of invertebrate pathology, 112(3), 243-252.
Bai, N., Zhang, W., Mai, K., Wang, X., Xu, W., & Ma, H. (2010). Effects of discontinuous administration of β-glucan and glycyrrhizin on the growth and immunity of white shrimp Litopenaeus vannamei. Aquaculture, 306(1-4), 218-224.
Bondad-Reantaso, M. G., Subasinghe, R. P., Arthur, J. R., Ogawa, K., Chinabut, S., Adlard, R., … & Shariff, M. (2005). Disease and health management in Asian aquaculture. Veterinary parasitology, 132(3-4), 249-272.
Burgents, J. E., K. G. Burnett, and L. E. Burnett. 2004. Disease resistance of Pacific white shrimp, Litopenaeus vannamei, following the dietary administration of a yeast culture food supplement. Aquaculture 231:1–8. doi:10.1016/j.aquaculture.2003.09.003.
Castex, M., Lemaire, P., Wabete, N., & Chim, L. (2010). Effect of probiotic Pediococcus acidilactici on antioxidant defences and oxidative stress of Litopenaeus stylirostris under Vibrio nigripulchritudo challenge. Fish & shellfish immunology, 28(4), 622-631.
Ceseña, C.E.; Vega-Villasante, F.; Aguirre-Guzmán, G.; Luna-Gonzalez, A.; Campa-Cordova, A.I. Update on the use of yeast in shrimp aquaculture: A mini review. Int. J. Aquat. Res. 2021, 13, 1–16.
Chi, Z., Z. Liu, L. Gao, F. Gong, C. Ma, X. Wang, and H. Li. 2006. Mine yeasts and their applications in mariculture. Journal of Ocean University of China 5:251–56. doi:10.1007/s11802-006-0010-5.
Deng D, Mei C, Mai K, Tan BP, Ai Q, Ma H (2013) Effects of a yeast-based additive on growth and immune responses of white shrimp, Litopenaeus vannamei (Boone, 1931), and aquaculture environment. Aquaculture Research 44: 1348–1357.
Felix, W., Oliveira, C., Moreira, R. A., Teixeira, J. A., & Domingues, L. (2008). Expression of frutalin, an α-D-galactose-binding jacalin-related lectin, in the yeast Pichia pastoris. Protein Expression and Purification, 60(2), 188-193.
Francis G., Makkar H.P.S. & Klaus B. (2001) Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish. Aquaculture, 199, 197–227.
Gamboa-Delgado, J., Navarro, Y.I.M., Nieto-Lopez, M.G., Villarreal-Cavazos, D.A., Cruz-Suarez, L.E. Assimilation of dietary nitrogen supplied by fish meal and microalgal biomass from Spirulina (Arthrospira platensis) and Nannochloropsis oculata in shrimp Litopenaeus vannamei fed compound diets. J Appl Phycol, 31 (2019), pp. 2379-2389.
Genc, M. A., Yilmaz, E., Genc, E., & Aktas, M. (2007). Effects of dietary mannan oligosaccharides (MOS) on growth, body composition, and intestine and liver histology of the hybrid tilapia (Oreochromis niloticus x 0. aureus). Israeli Journal of Aquaculture-Bamidgeh, 59.
Genc, M. A., & Ebeoglu, B. (2013). The effects of different salinity and supplemented mannan oligosaccharides (MOS) on growth of Litopenaeus varmamei (Penaeus: Decapoda). J. Anim. Veterin. Adv, 12(9), 942-947.
Guo, Y., Zhang, B., Wang, W., Li, Z., Han, Q., D’inca, R. (2016). Dietary live yeast and mannan-oligosaccharide supplementation attenuate intestinal inflammation and barrier dysfunction induced by Escherichia coli in broilers. British Journal of Nutrition, 116(11), 1878-1888.
Heu, M.-S.; Kim, J.-S.; Shahidi, F. Components and nutritional quality of shrimp processing by-products. Food Chem. 2003, 82, 235–242
Hu, L., Yun, B., Xue, M., Wang, J., Wu, X., Zheng, Y., Han, F., 2013. Effects of fish meal quality and fish meal substitution by animal protein blend on growth performance, flesh quality and liver histology of Japanese seabass (Lateolabrax japonicus). Aquaculture 372-375, 52–61.
Jin, W., Yang, K., Barzilay, R., & Jaakkola, T. (2018). Learning multimodal graph-to-graph translation for molecular optimization. arXiv preprint arXiv:1812.01070.
Li, W., Lu, H., He, Z., Sang, Y., & Sun, J. (2021). Quality characteristics and bacterial community of a Chinese salt-fermented shrimp paste. LWT, 136, 110358.
Nimrat, S., Khaopong, W., Sangsong, J., Boonthai, T., & Vuthiphandchai, V. (2021). Dietary administration of Bacillus and yeast probiotics improves the growth, survival, and microbial community of juvenile whiteleg shrimp, Litopenaeus vannamei. Journal of Applied Aquaculture, 33(1), 15-31.
Oujifard A, Seyfabadi J, Kenari AA, Rezaei M. 2012. Growth and apparent digestibility of nutrients, fatty acids and amino acids in Pacific white shrimp, Litopenaeus vannamei, fed diets with rice protein concentrate as total and partial replacement of fish meal. Aquaculture 342-343:56e61.
Rostagno, H.S., Albino, L.F.T., Hannas, M.I., Donzele, J.L., Sakomura, N.K., Perazzo, F.G., Saraiva, A., Teixeira, M.L., Rodrigues, P.B., Oliveira, R.F., Barreto, S.L. Oliveira Brito, C. Tabelas Brasileiras para Aves e Suínos. H.S. Rostagno (Ed.), Composiçao de Alimentos e Exigencias Nutricionais (4th ed.), Universidade Federal de Viçosa, Viçosa, Brazil (2017).
Sabry Neto, H., Santaella, S. T., & Nunes, A. J. P. (2015). Bioavailability of crude protein and lipid from biofloc meals produced in an activated sludge system for white shrimp, Litopenaeus vannamei. Revista Brasileira de Zootecnia, 44, 269-275.
Sajeevan, T.P., Rosamma Philip, I.S. Bright Singh, Dose/frequency: A critical factor in the administration of glucan as immunostimulant to Indian white shrimp Fenneropenaeus indicus, Aquaculture, Volume 287, Issues 3–4, 2009, Pages 248-252, ISSN 0044-8486, https://doi.org/10.1016/j.aquaculture.2008.10.045.
Sajeevan, T.P., Lowman, D.W., Williams, D.L., Selven, S., Anas, A. and Rosamma, P. (2009), Marine yeast diet confers better protection than its cell wall component (1-3)-β-d-glucan as an immunostimulant in Fenneropenaeus indicus. Aquaculture Research, 40: 1723-1730. https://doi.org/10.1111/j.1365-2109.2009.02275.x
Sang, X., Oni, A. A., & LeBeau, J. M. (2014). Atom column indexing: atomic resolution image analysis through a matrix representation. Microscopy and Microanalysis, 20(6), 1764-1771.
Sookying, D.; Davis, D. A. and Silva, F.S.D. 2013. A review of the development and application of soybean-based diets for Pacif white shrimp Litopenaeus vannamei. Aquaculture Nutrition 19:441-448. doi: 10.1111/anu.12050.
Sukumaran, V., Lowman, D. W., Sajeevan, T. P., & Philip, R. (2010). Marine yeast glucans confer better protection than that of baker’s yeast in Penaeus monodon against white spot syndrome virus infection. Aquaculture Research, 41(12), 1799-1805.
Sweetman J. (2008) The role of yeast derived proteins in modern aqua feed formulations. International AquaFeed, 8, 19–23.
UNICA – União da Indústria de Cana de Açúcar. https://unicadata.com.br/. 01/09/2023.
Zhang, G. L., Ma, X., X. Fan, P., Li, L. S., Qiao, S. Y. & Li, D. F. (2012). Butyrate promotes the recovering of intestinal wound healing through its positive effect on the tight junctions. Journal of animal science, 90(suppl_4), 266-268.
Zhenming, C., Zhiqiang, L., Lingmei, G. et al. Marine yeasts and their applications in mariculture. J Ocean Univ. China 5, 251–256 (2006). https://doi.org/10.1007/s11802-006-0010-5.
Zhu XZ, Liu YJ, Tian LX, Mai KS, Zheng SX, Pan QJ et al. (2010) Effects of dietary protein and lipid levels on growth and energy productive value of pacific white shrimp, Litopenaeus vannamei, at different salinities. Aquaculture Nutrition 16: 392–399.
Wilson, M. J., Frickel, S., Nguyen, D., Bui, T., Echsner, S., Simon, B. R., … & Wickliffe, J. K. (2015). A targeted health risk assessment following the Deepwater Horizon oil spill: polycyclic aromatic hydrocarbon exposure in Vietnamese-American shrimp consumers. Environmental health perspectives, 123(2), 152-159.
Publicado en 23 octubre de 2023


