Fontes proteicas sustentáveis na dieta de camarões

Prof. Dr. Fernando Augusto de Souza
Técnico especialista em Monogástrica, ICC Brazil
A proteína é o nutriente mais pesado na dieta de camarões, principalmente devido à inclusão de farinha de peixe (Oujifard et al, 2012). A qualidade da farinha de peixe é determinada por uma série de fatores, incluindo o tipo de peixe utilizado, o método de processamento e as condições de armazenamento. Refeições de boa qualidade são geralmente obtidas a partir de peixes com alto valor nutricional, como sardinha, anchova e atum.
Além dos fatores de qualidade, a disponibilidade de farinha de peixe é extremamente limitante, pois é um ingrediente finito que depende da capacidade de renovação dos cardumes, ou seja, é limitada e insustentável, obtida a partir da pesca predatória que, na maioria dos casos, não respeita o ciclo reprodutivo dos peixes (Sookying et al, 2013). Nesse sentido, tornam-se essenciais recursos sustentáveis, com possibilidades de crescimento e oferta do mercado de camarão no longo prazo.
Disponibilidade
É possível reduzir o uso de farinha de peixe combinando outras proteínas mais baratas e com uma combinação de aminoácidos que atenda às necessidades do camarão. Algumas alternativas são: farinha animal proveniente do abatedouro de aves, suínos e bovinos, farinha de sangue seca por pulverização, leveduras, proteínas de origem bacteriana, entre outras (Hu et al, 2013).
Farinhas de origem animal, como farinhas de carne e ossos, contêm altos níveis de metionina, o que teoricamente se torna uma boa alternativa para substituir a farinha de peixe, mas é um produto cujo uso é proibido na dieta animal em alguns países da União Europeia, além de apresentar alguns problemas de palatabilidade e contaminantes (Sweetman, 2008).
Proteínas vegetais, como o farelo de soja, são utilizadas na alimentação de peixes e camarões como fonte alternativa de proteína. No entanto, deve-se atentar para os fatores antinutricionais, que podem afetar adversamente o desempenho animal, tais como: inibidores de protease e taninos, antivitamínicos e outras substâncias, como fitoestrógenos (Francis, Makkar & Klaus 2001).
Atualmente, as leveduras representam uma importante fonte de proteína capaz de substituir (total ou parcialmente) a farinha de peixe (Alloul et al, 2021). É um ingrediente com ampla disponibilidade e preços competitivos. No Brasil, apenas 10% do total produzido atualmente é utilizado para alimentação animal, de uma quantidade de 1 milhão de toneladas, apenas 100 mil toneladas são utilizadas (UNICA, 2023).
Características nutricionais
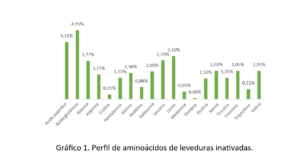
As leveduras são um produto bem conhecido na aquicultura (integral ou fracionada) como fonte de aminoácidos (Figura 1), proteínas, minerais e vitaminas, com efeito positivo no crescimento e imunidade do camarão (Gamboa-Delgado et al. 2016; Álvarez-Sánchez et al., 2018). Outro ponto é a presença do ácido glutâmico e do ácido aspártico, que estão relacionados ao processo de atratividade e palatabilidade em dietas (Heu et al, 2003).
O uso de leveduras varia de acordo com o seu processamento. Quando apenas inativadas e secas, as leveduras são utilizadas como fonte proteica e podem fornecer até 45% de proteína com digestibilidade próxima a 70%. Se processado, no caso da autólise pode chegar a 80% e se hidrolisado ultrapassa 80% (Rostagno et al, 2017). Há também casos em que se deseja usá-lo apenas como alimento funcional, pois são fontes de β-glucanos e mananoligossacarídeos, que por sua vez ajudam a fortalecer o sistema imunológico e se ligam a patógenos, respectivamente (Chi et al, 2006).
Sustentabilidade e meio ambiente
As leveduras desempenham um papel importante no controle e resistência a várias doenças. De acordo com Ceseña et al. (2021) elas podem ser utilizadas, além de seu valor nutricional, como antioxidantes e imunoestimulantes, o que permite reduzir o uso de antibióticos em animais comerciais.
Outro ponto é a sustentabilidade do produto em seu processo produtivo e com o meio ambiente. As leveduras provenientes da fabricação do etanol estão inseridas em uma atividade com produção negativa de carbono e que conseguiu reduzir em mais de 630 milhões de toneladas de CO2eq desde março de 2022 no Brasil, ou seja, para alcançar essa economia de CO2 seria necessário plantar mais de 4.500 milhões de árvores nativas nos próximos 20 anos (UNICA, 2023).
É também um produto que permite reduzir o uso de antibióticos, medicamentos e outros produtos químicos, uma vez que não afeta o ambiente aquático. A qualidade da água é um ponto muito importante para entender e controlar doenças e patógenos, além de evitar a poluição ambiental, seja com moléculas que degradam o meio ambiente ou microrganismos, seja afetando a biodiversidade. As leveduras já fazem parte do ambiente ou da microbiota dos organismos aquáticos e são capazes de melhorar o bem-estar e a saúde animal, influenciando o ambiente microecológico (Deng et al, 2013). Os mesmos autores observaram que com o uso de Saccharomyces cerevisiae diretamente na água houve redução na quantidade de NH3, demanda química de oxigênio e sulfitos na água e sedimentos da lagoa.
Sistema imunológico e prevenção de doenças
O uso de leveduras e seus produtos representa uma possível e viável estratégia de prevenção e controle de doenças para melhorar a qualidade e a sustentabilidade da produção aquícola. Vários estudos (Burgents et al., 2004; 2006: Sajeevan et al., 2009a,b; 2010, 2014; Babu et al., 2013; Deng et al., 2013; Sang et al., 2014; Wilson et al., 2015; Neto e Nunes 2015; Jin et al., 2018), demonstraram efeitos benéficos sobre componentes do sistema imune do camarão, tais como: efeitos sobre proteínas anticoagulantes, aglutinação de patógenos, efeito antioxidante, melhora nos componentes humorais, atividade lisozima, processos de fagocitose, entre outros.
Alguns estudos (Felix et al. 2008; Guo et al. 2016) demonstraram a eficácia do uso de levedura em condições de vibriose sobre o desempenho do camarão e contra o vírus da mionecrose (IMNV) e da mancha branca (WSSV) em L. vannamei (Sukumaran et al. 2010; Zhu et al, 2010; Neto e Nunes, 2015; Wilson et al., 2015). Estes resultados demonstram a atividade imunoestimulatória dos β-glucanos 1,3 e 1,6 suplementados com levedura. Os imunoestimulantes podem aumentar a fagocitose de patógenos ativando células fagocíticas na hemolinfa, aumentando as propriedades antibacterianas e antissépticas da hemolinfa, ativando o sistema PROPO e mediando sinais de reconhecimento e fagocitose (Bondad-Reantaso et al. 2005; Castex et al., 2010).
Ao lado dos β-glucanos na parede celular da levedura também estão os mananoligossacarídeos (MOS). São um complexo de carboidratos indigestos que impedem a adesão de bactérias patogênicas, pois atuam bloqueando a adesão de lectinas microbianas aos carboidratos presentes na superfície das células intestinais. A não aderência à membrana intestinal inibe a colonização do patógeno infeccioso, que é eliminado nas fezes (Genc et al., 2007; Zhang et al., 2012; Genc e Ebeoglu 2013; Sang et al., 2014).
Todos esses mecanismos, além de proporcionarem melhorias produtivas (Chi et al, 2016), também permitem uma redução na mortalidade animal (Nimrat et al, 2019) decorrente dos benefícios observados e da capacidade de resposta dos animais aos desafios.
Considerações finais
O uso de leveduras na alimentação de camarões é bastante sólido no sentido nutricional e funcional, ou seja, são uma fonte alternativa à farinha de peixe, com potencial de suprimento e suprimento a longo prazo, além de serem sustentáveis. Eles permitem reduzir o uso de antibióticos e outros medicamentos, pois têm efeito direto modulando o sistema imunológico e aglutinando patógenos, além de não agredir o ambiente aquático.
Referências
Alloul, A.; Wille, M.; Lucenti, P.; Bossier, P.; Van Stappen, G.; Vlaeminck, S.E. Purple Bacteria as Added-Value Protein Ingredient in Shrimp Feed: Penaeus vannamei Growth Performance, and Tolerance against Vibrio and Ammonia Stress. Aquaculture 2021, 530, 735788.
Alvarez-Sanchez, A.R., Nolasco, H., Pena, A., Mejia, H. In vitro digestibility of Yarrowia lipolytica yeast and growth performance in whiteleg shrimp Litopenaeus vannamei. J Fish Aquat Sci, 18 (2018).
Babu, D. T., Antony, S. P., Joseph, S. P., Bright, A. R., & Philip, R. (2013). Marine yeast Candida aquaetextoris S527 as a potential immunostimulant in black tiger shrimp Penaeus monodon. Journal of invertebrate pathology, 112(3), 243-252.
Bai, N., Zhang, W., Mai, K., Wang, X., Xu, W., & Ma, H. (2010). Effects of discontinuous administration of β-glucan and glycyrrhizin on the growth and immunity of white shrimp Litopenaeus vannamei. Aquaculture, 306(1-4), 218-224.
Bondad-Reantaso, M. G., Subasinghe, R. P., Arthur, J. R., Ogawa, K., Chinabut, S., Adlard, R., … & Shariff, M. (2005). Disease and health management in Asian aquaculture. Veterinary parasitology, 132(3-4), 249-272.
Burgents, J. E., K. G. Burnett, and L. E. Burnett. 2004. Disease resistance of Pacific white shrimp, Litopenaeus vannamei, following the dietary administration of a yeast culture food supplement. Aquaculture 231:1–8. doi:10.1016/j.aquaculture.2003.09.003.
Castex, M., Lemaire, P., Wabete, N., & Chim, L. (2010). Effect of probiotic Pediococcus acidilactici on antioxidant defences and oxidative stress of Litopenaeus stylirostris under Vibrio nigripulchritudo challenge. Fish & shellfish immunology, 28(4), 622-631.
Ceseña, C.E.; Vega-Villasante, F.; Aguirre-Guzmán, G.; Luna-Gonzalez, A.; Campa-Cordova, A.I. Update on the use of yeast in shrimp aquaculture: A mini review. Int. J. Aquat. Res. 2021, 13, 1–16.
Chi, Z., Z. Liu, L. Gao, F. Gong, C. Ma, X. Wang, and H. Li. 2006. Mine yeasts and their applications in mariculture. Journal of Ocean University of China 5:251–56. doi:10.1007/s11802-006-0010-5.
Deng D, Mei C, Mai K, Tan BP, Ai Q, Ma H (2013) Effects of a yeast-based additive on growth and immune responses of white shrimp, Litopenaeus vannamei (Boone, 1931), and aquaculture environment. Aquaculture Research 44: 1348–1357.
Felix, W., Oliveira, C., Moreira, R. A., Teixeira, J. A., & Domingues, L. (2008). Expression of frutalin, an α-D-galactose-binding jacalin-related lectin, in the yeast Pichia pastoris. Protein Expression and Purification, 60(2), 188-193.
Francis G., Makkar H.P.S. & Klaus B. (2001) Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish. Aquaculture, 199, 197–227.
Gamboa-Delgado, J., Navarro, Y.I.M., Nieto-Lopez, M.G., Villarreal-Cavazos, D.A., Cruz-Suarez, L.E. Assimilation of dietary nitrogen supplied by fish meal and microalgal biomass from Spirulina (Arthrospira platensis) and Nannochloropsis oculata in shrimp Litopenaeus vannamei fed compound diets. J Appl Phycol, 31 (2019), pp. 2379-2389.
Genc, M. A., Yilmaz, E., Genc, E., & Aktas, M. (2007). Effects of dietary mannan oligosaccharides (MOS) on growth, body composition, and intestine and liver histology of the hybrid tilapia (Oreochromis niloticus x 0. aureus). Israeli Journal of Aquaculture-Bamidgeh, 59.
Genc, M. A., & Ebeoglu, B. (2013). The effects of different salinity and supplemented mannan oligosaccharides (MOS) on growth of Litopenaeus varmamei (Penaeus: Decapoda). J. Anim. Veterin. Adv, 12(9), 942-947.
Guo, Y., Zhang, B., Wang, W., Li, Z., Han, Q., D’inca, R. (2016). Dietary live yeast and mannan-oligosaccharide supplementation attenuate intestinal inflammation and barrier dysfunction induced by Escherichia coli in broilers. British Journal of Nutrition, 116(11), 1878-1888.
Heu, M.-S.; Kim, J.-S.; Shahidi, F. Components and nutritional quality of shrimp processing by-products. Food Chem. 2003, 82, 235–242
Hu, L., Yun, B., Xue, M., Wang, J., Wu, X., Zheng, Y., Han, F., 2013. Effects of fish meal quality and fish meal substitution by animal protein blend on growth performance, flesh quality and liver histology of Japanese seabass (Lateolabrax japonicus). Aquaculture 372-375, 52–61.
Jin, W., Yang, K., Barzilay, R., & Jaakkola, T. (2018). Learning multimodal graph-to-graph translation for molecular optimization. arXiv preprint arXiv:1812.01070.
Li, W., Lu, H., He, Z., Sang, Y., & Sun, J. (2021). Quality characteristics and bacterial community of a Chinese salt-fermented shrimp paste. LWT, 136, 110358.
Nimrat, S., Khaopong, W., Sangsong, J., Boonthai, T., & Vuthiphandchai, V. (2021). Dietary administration of Bacillus and yeast probiotics improves the growth, survival, and microbial community of juvenile whiteleg shrimp, Litopenaeus vannamei. Journal of Applied Aquaculture, 33(1), 15-31.
Oujifard A, Seyfabadi J, Kenari AA, Rezaei M. 2012. Growth and apparent digestibility of nutrients, fatty acids and amino acids in Pacific white shrimp, Litopenaeus vannamei, fed diets with rice protein concentrate as total and partial replacement of fish meal. Aquaculture 342-343:56e61.
Rostagno, H.S., Albino, L.F.T., Hannas, M.I., Donzele, J.L., Sakomura, N.K., Perazzo, F.G., Saraiva, A., Teixeira, M.L., Rodrigues, P.B., Oliveira, R.F., Barreto, S.L. Oliveira Brito, C. Tabelas Brasileiras para Aves e Suínos. H.S. Rostagno (Ed.), Composiçao de Alimentos e Exigencias Nutricionais (4th ed.), Universidade Federal de Viçosa, Viçosa, Brazil (2017).
Sabry Neto, H., Santaella, S. T., & Nunes, A. J. P. (2015). Bioavailability of crude protein and lipid from biofloc meals produced in an activated sludge system for white shrimp, Litopenaeus vannamei. Revista Brasileira de Zootecnia, 44, 269-275.
Sajeevan, T.P., Rosamma Philip, I.S. Bright Singh, Dose/frequency: A critical factor in the administration of glucan as immunostimulant to Indian white shrimp Fenneropenaeus indicus, Aquaculture, Volume 287, Issues 3–4, 2009, Pages 248-252, ISSN 0044-8486, https://doi.org/10.1016/j.aquaculture.2008.10.045.
Sajeevan, T.P., Lowman, D.W., Williams, D.L., Selven, S., Anas, A. and Rosamma, P. (2009), Marine yeast diet confers better protection than its cell wall component (1-3)-β-d-glucan as an immunostimulant in Fenneropenaeus indicus. Aquaculture Research, 40: 1723-1730. https://doi.org/10.1111/j.1365-2109.2009.02275.x
Sang, X., Oni, A. A., & LeBeau, J. M. (2014). Atom column indexing: atomic resolution image analysis through a matrix representation. Microscopy and Microanalysis, 20(6), 1764-1771.
Sookying, D.; Davis, D. A. and Silva, F.S.D. 2013. A review of the development and application of soybean-based diets for Pacif white shrimp Litopenaeus vannamei. Aquaculture Nutrition 19:441-448. doi: 10.1111/anu.12050.
Sukumaran, V., Lowman, D. W., Sajeevan, T. P., & Philip, R. (2010). Marine yeast glucans confer better protection than that of baker’s yeast in Penaeus monodon against white spot syndrome virus infection. Aquaculture Research, 41(12), 1799-1805.
Sweetman J. (2008) The role of yeast derived proteins in modern aqua feed formulations. International AquaFeed, 8, 19–23.
UNICA – União da Indústria de Cana de Açúcar. https://unicadata.com.br/. 01/09/2023.
Zhang, G. L., Ma, X., X. Fan, P., Li, L. S., Qiao, S. Y. & Li, D. F. (2012). Butyrate promotes the recovering of intestinal wound healing through its positive effect on the tight junctions. Journal of animal science, 90(suppl_4), 266-268.
Zhenming, C., Zhiqiang, L., Lingmei, G. et al. Marine yeasts and their applications in mariculture. J Ocean Univ. China 5, 251–256 (2006). https://doi.org/10.1007/s11802-006-0010-5.
Zhu XZ, Liu YJ, Tian LX, Mai KS, Zheng SX, Pan QJ et al. (2010) Effects of dietary protein and lipid levels on growth and energy productive value of pacific white shrimp, Litopenaeus vannamei, at different salinities. Aquaculture Nutrition 16: 392–399.
Wilson, M. J., Frickel, S., Nguyen, D., Bui, T., Echsner, S., Simon, B. R., … & Wickliffe, J. K. (2015). A targeted health risk assessment following the Deepwater Horizon oil spill: polycyclic aromatic hydrocarbon exposure in Vietnamese-American shrimp consumers. Environmental health perspectives, 123(2), 152-159.
Acesse immunowall.com
Publicado em 23 outubro de 2023


